
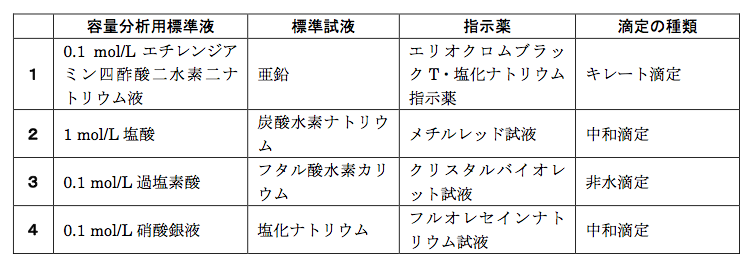
自動滴定装置 技術資料 銅イオン選択性電極を用いたキレート滴定 技術資料 事例集 メトロームジャパン イプロスものづくり
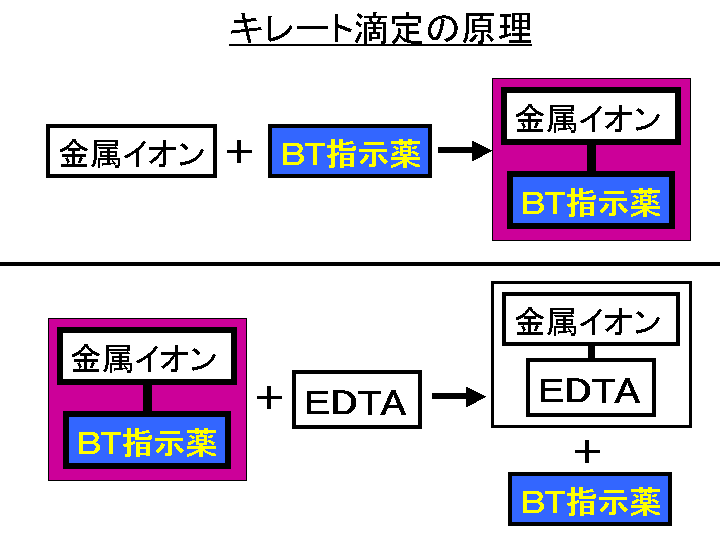
3.edtaによるキレート滴定 競技では,edtaによるキレート滴定の原理やebt指示薬やnn指示薬を用いてca2+ やmg2+ を定量する具体的な方法を問題文の1,2ページに記載し,初学者にも充分理解で きるように配慮した。次に実験操作の手順を簡潔に示す。キレート滴定,酸化還元滴定,沈殿滴定の四種類が挙げられる。 3.1.1 酸塩基滴定 酸塩基滴定は中和滴定とも呼ばれ,酸と塩基の中和反応に 基づく滴定方法で各種処理液の酸濃度,アルカリ濃度の分析 に用いる。例として,01 mol/L HCl 10 mL を01 mol/L NaOH
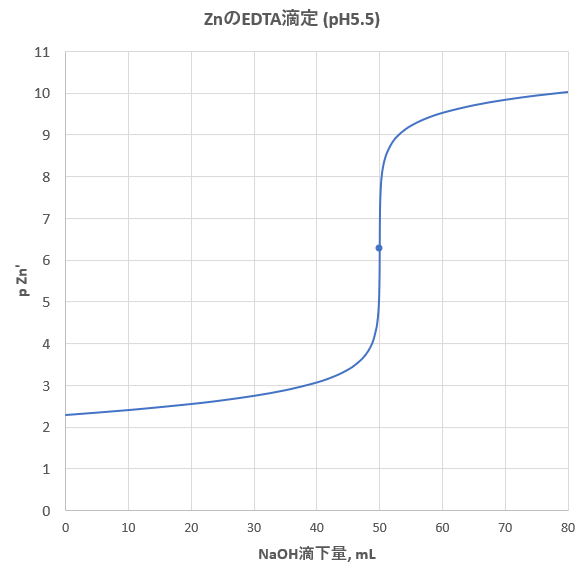
キレート滴定 計算 亜鉛
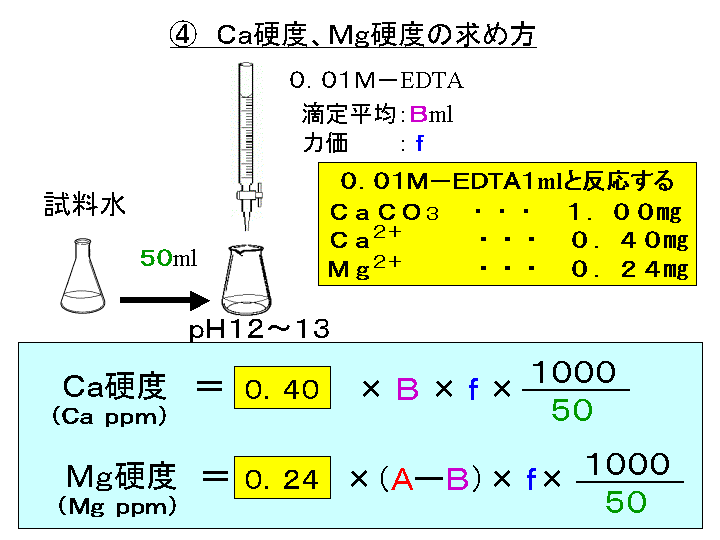
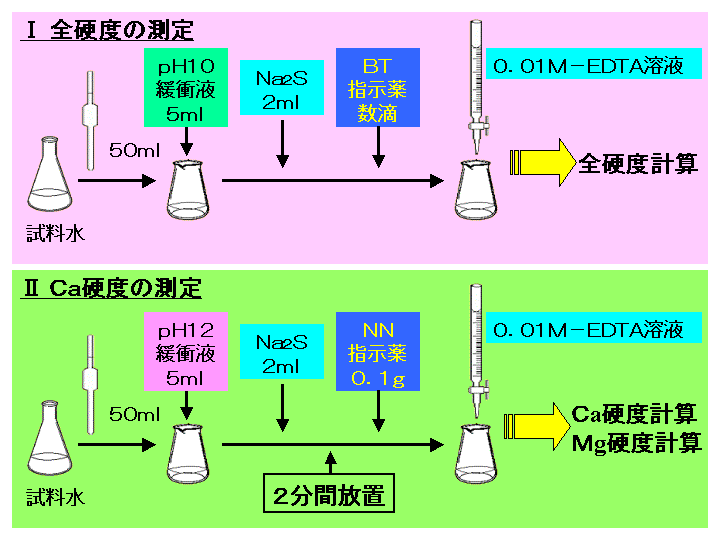
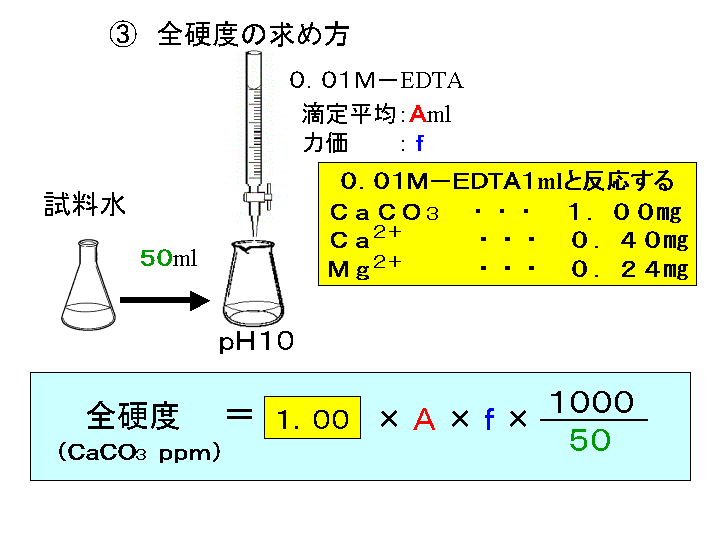
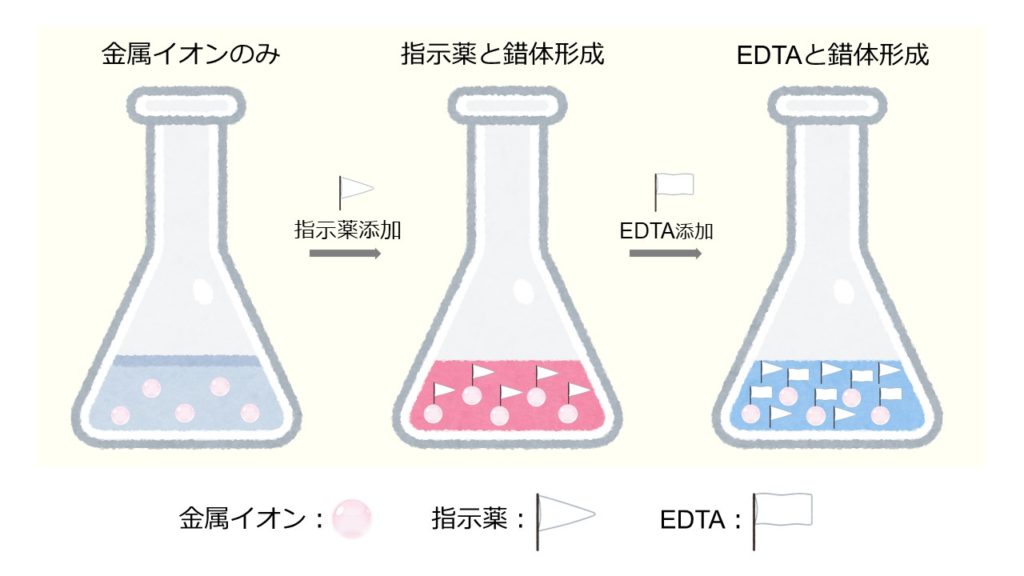
キレート滴定 計算 亜鉛-水の硬度とは、水に溶けているCa 2+ およびMg 2+ の量をCaCO 3 (ppm)に換算したものである。 硬度には、全硬度(Ca 2+ とMg 2+ )、Ca硬度、およびMg硬度がある。 EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合し(5) 滴定・終点操作 (ア) 手際よく滴定操作ができている。 (イ) 終点の判断が適切である。 3 完成度・結果について 1 報告書 (1) 反応式・計算式など必要なものが記入されている。 (2) 反応式に基づいた計算が正しくされている。 (3) 誤差を考慮している。

キレート滴定に用いられる主な標準液 指示薬のゴロ 覚え方 ごろごろ覚える薬学生ゴロ 薬剤師国家試験対策
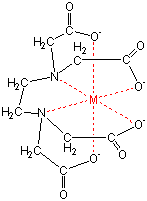
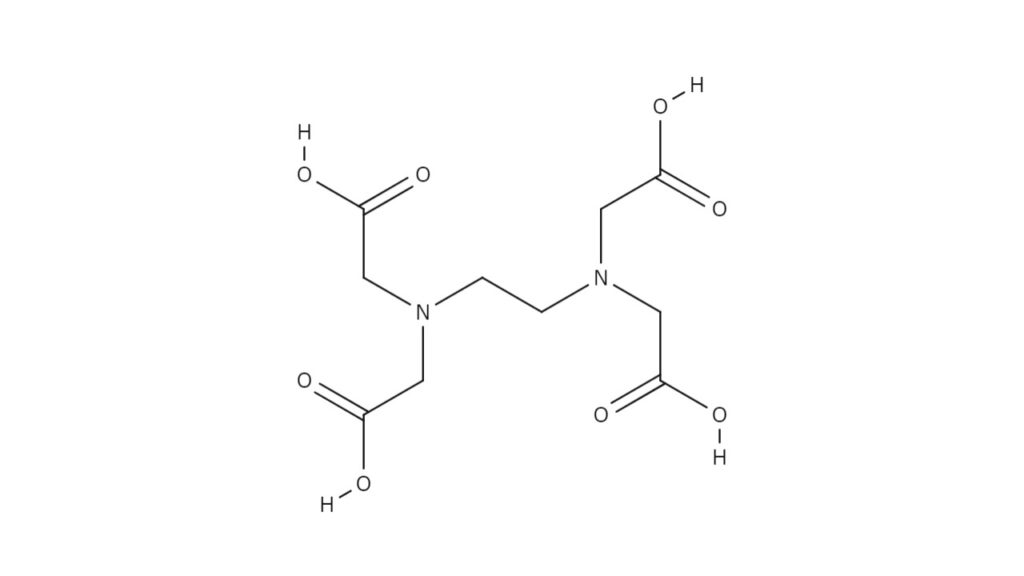
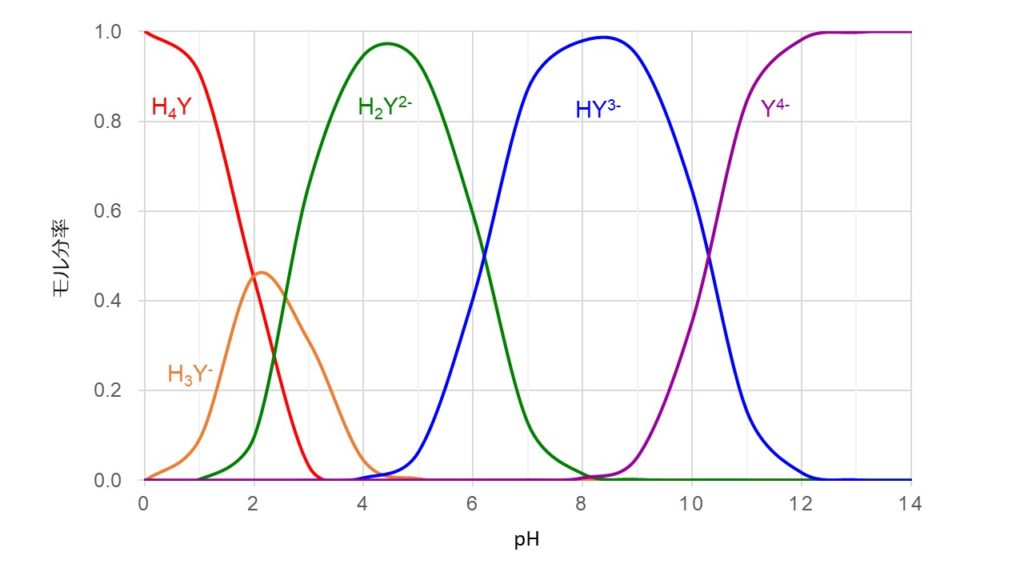
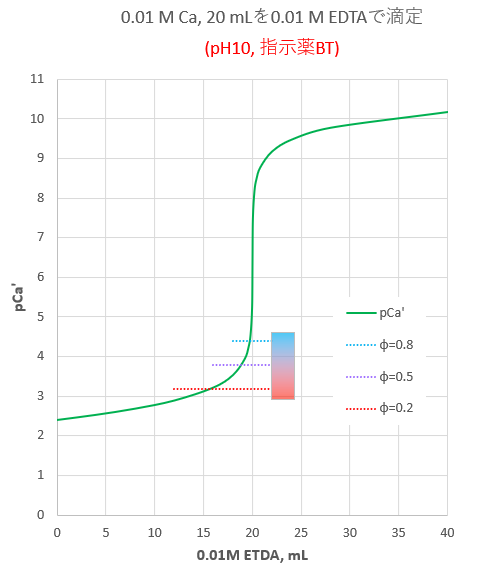
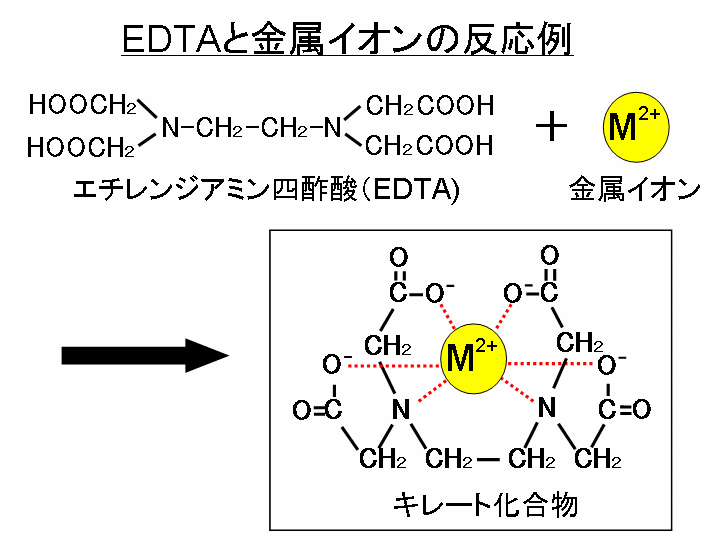
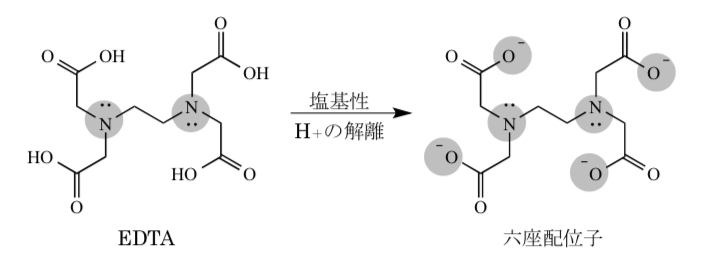
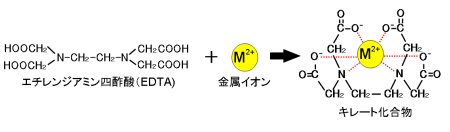
キレート滴定 エチレンジアミン四酢酸(edta、h 4 yと略記)は、水溶液中で金属イオンと反応し、 非常に安定な金属キレート化合物を作る。 キレート滴定は、そのことを利用した容量分析法である。キレート生成反応は、 である。EDTA と金属キレートのK f 値→p18, 表12 <例:EDTA とMg2> K f = 49×108 log K f = 8 log 49 = 869 ML n M Ln 8 キレート滴定 多座配位子EDTA(標準液)が 金属イオン(Zn 2, Mg 2, Ca , Al3, Cu 等)と 水溶液中で安定な可溶性のキレート化合物を生成する ことを利用した亜鉛,カドミウム,コバルト,銅,鉛,マンガン標準液のedtaキレート滴定法に基づく,亜鉛を基準物質とするトレーサビリテイ 著者 日置,昭治他 出版者 日本分析化学会 出版年月日 掲載雑誌名 分析化学 38(9) 提供制限 インターネット公開 原資料(url)
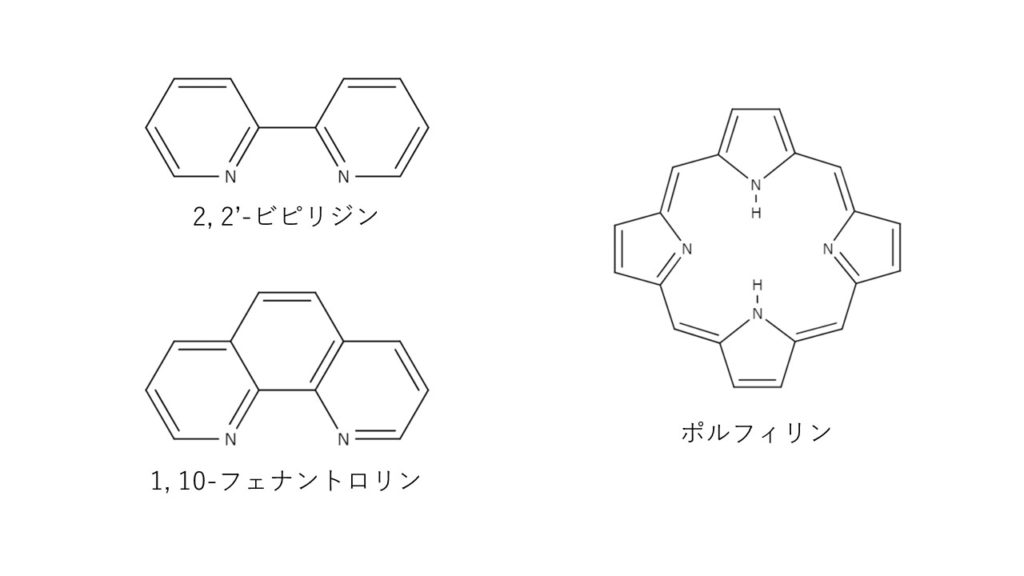
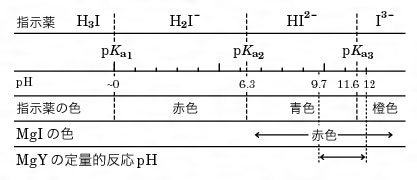
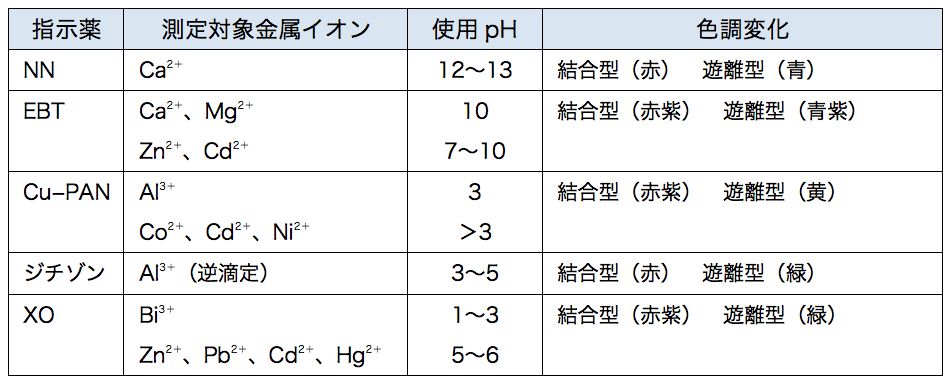
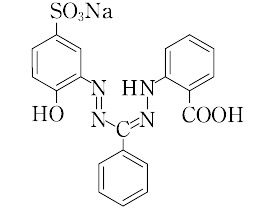
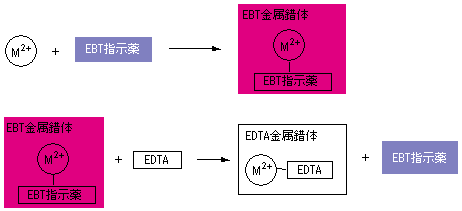
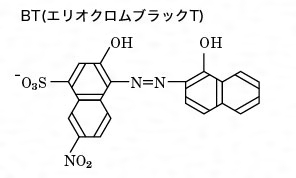
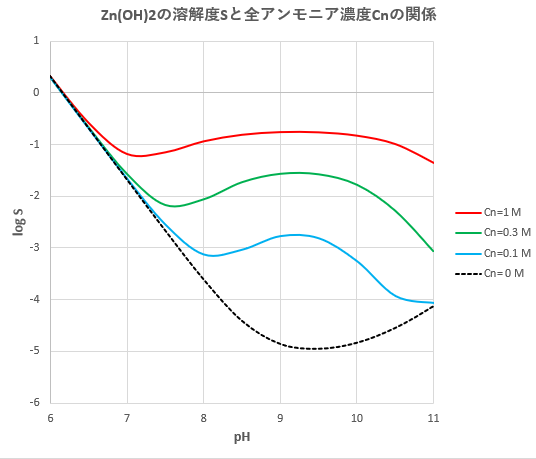
2.キレート効果 (text p) 二座以上の配位子が金属イオンを挟むような形で錯体を形成するとき,中心金属と配位原子を含む環 ができる.このような錯体をキレート(金属キレートあるいはキレート化合物)とよぶ.キレート滴定ではpH により試料と滴定試薬との反応性が変化するため、pH 調節は規定通り ・コバルト、ニッケル、銅、亜鉛、カドミウム、水銀 : 80g/Lシアン化ナトリウム溶液2mLを添加 上記の計算式で、カルシウム、マグネシウムの合量およびキレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63
キレート滴定 計算 亜鉛のギャラリー
各画像をクリックすると、ダウンロードまたは拡大表示できます
 |  | |
 |  | |
 |  |  |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  | |
 |  | |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  | |
 |  | |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 | ||
 |  | |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 | ||
 |  |  |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |  |
 |  | |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 | ||
 |  |  |
 |  |  |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  |  |
 |  |  |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  |  |
 |  |  |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |  |
 | ||
「キレート滴定 計算 亜鉛」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |
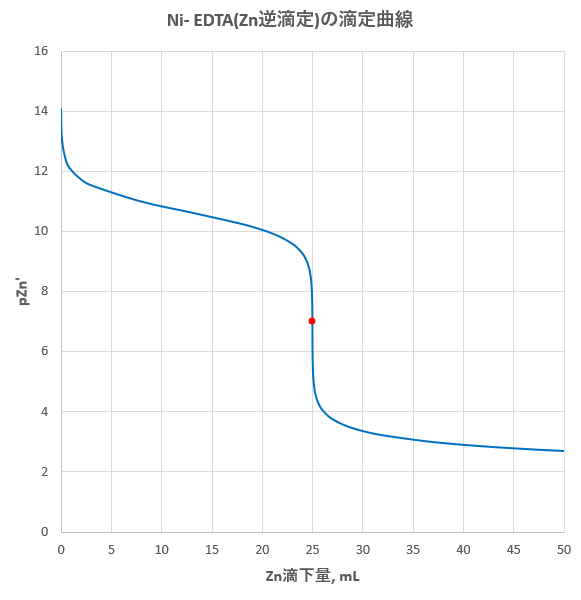
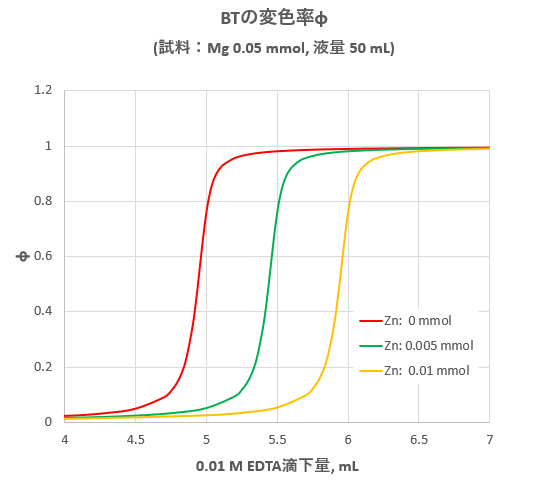
ビュレットに001 mol/L塩化亜鉛溶液を入れる。 空滴定001 mol/L EDTAをホールピペットを用いて精確に10 mLコニカルビーカーに取り、 イオン交換水を mL程度加え、塩化アンモニウム-アンモニア緩衝溶液約1 mL、EBT指示薬を数滴加えて、塩化亜鉛溶液で滴定が,ph6に おいて亜鉛,カ ドミウムのうち,カ ドミウ ムのみと安定なキレートを生成して,edtaに よるキ レート滴定からいんぺいすることが知られているす な わち鉛と同量以下のカドミウムは,ジ メルカプ
Incoming Term: キレート滴定 計算 亜鉛,



